醫療器械“領證”大(dà)軍繼續擴員(yuán)。全國範圍内,二類醫療器械唯一标識正式來(lái)襲。
2月(yuè)17日,國家藥監局、國家衛健委、國家醫保局發布《關于做(zuò)好第三批實施醫療器械唯一标識工作的(de)公告》,提出開展第三批醫療器械唯一标識工作。
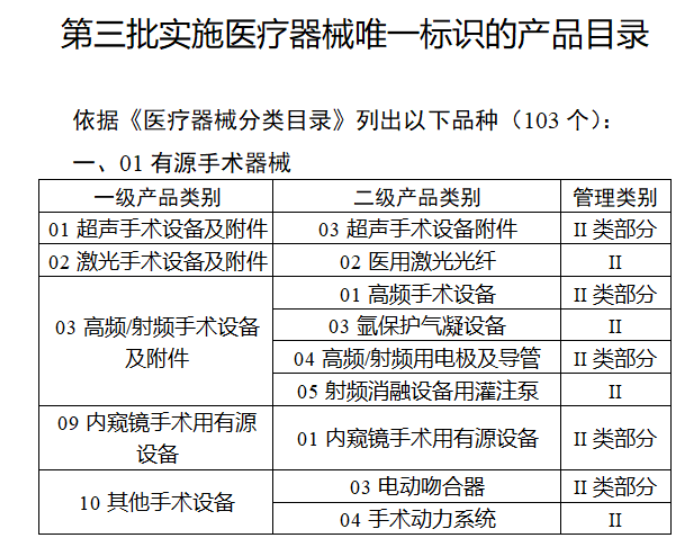
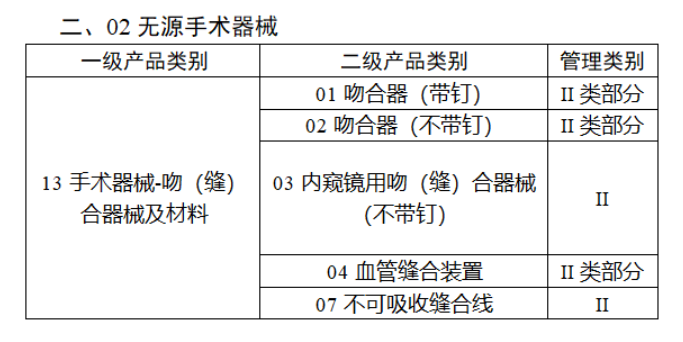
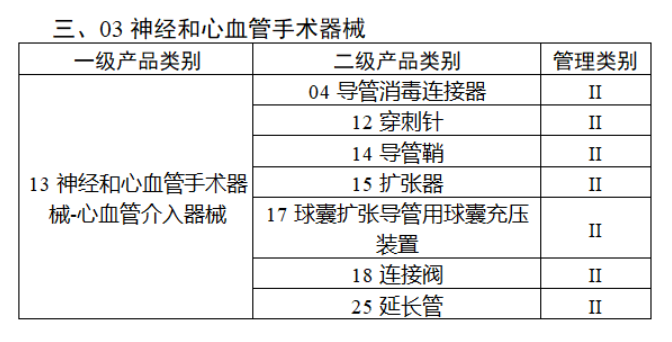
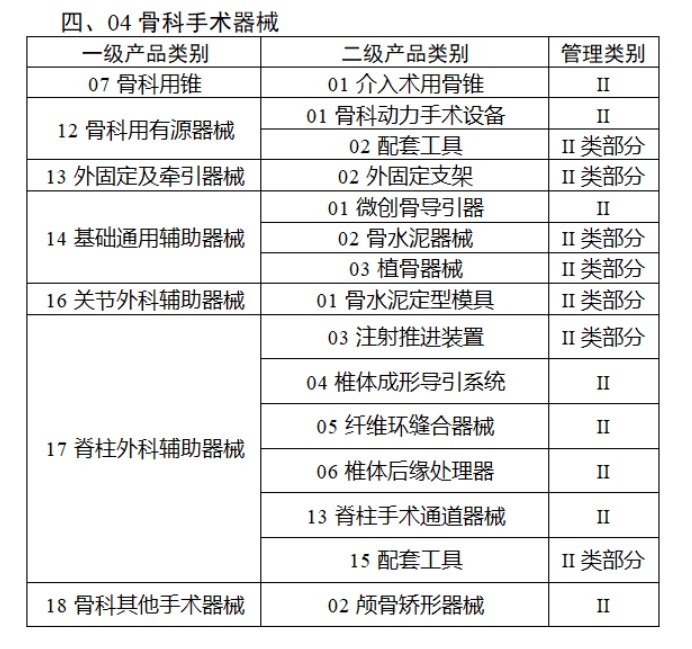
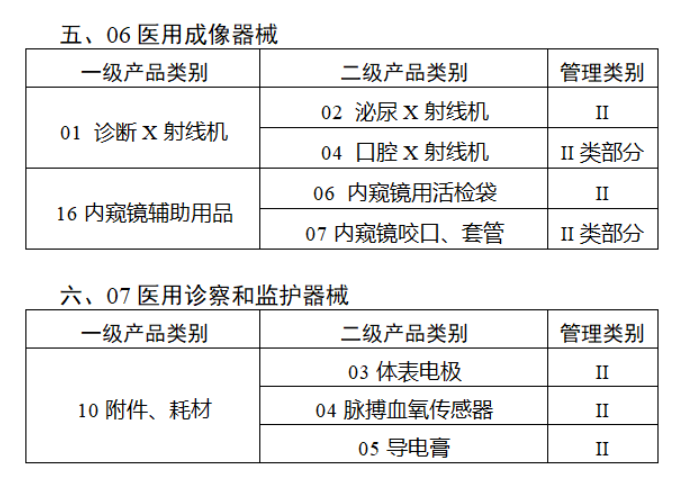
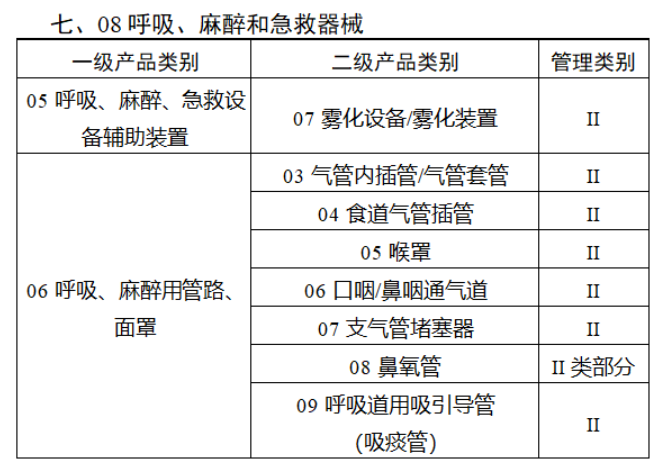
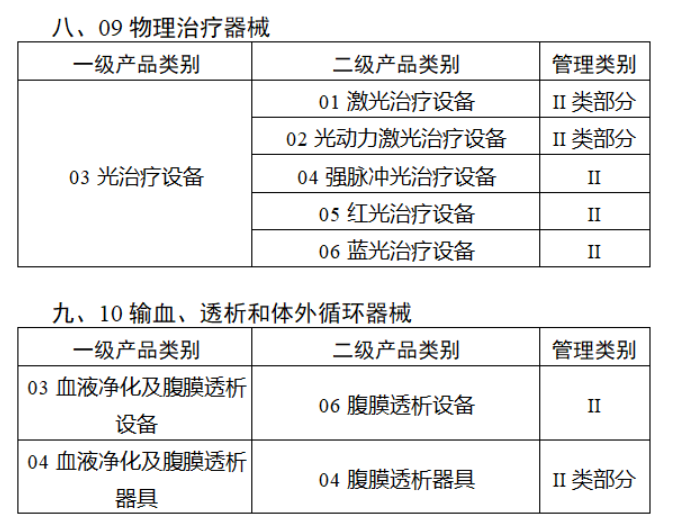
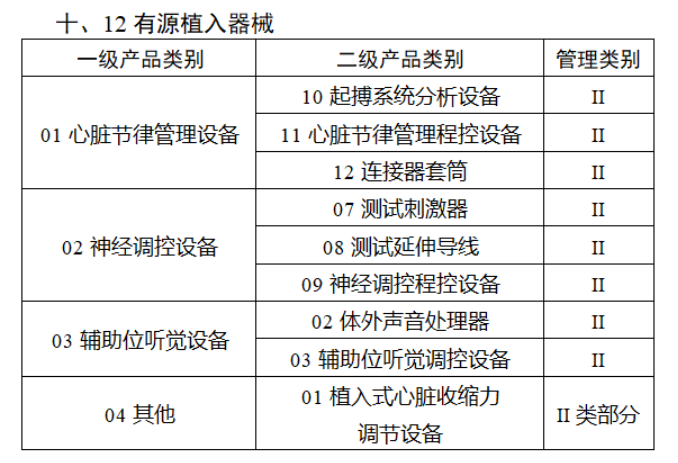
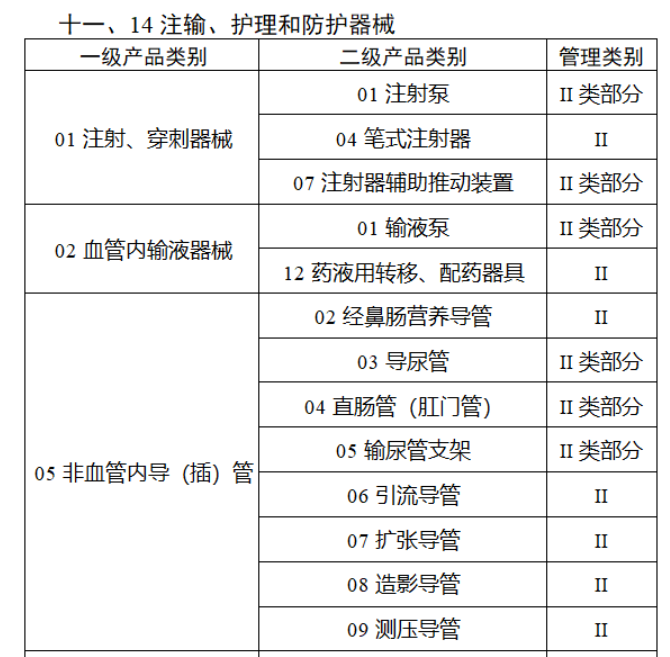
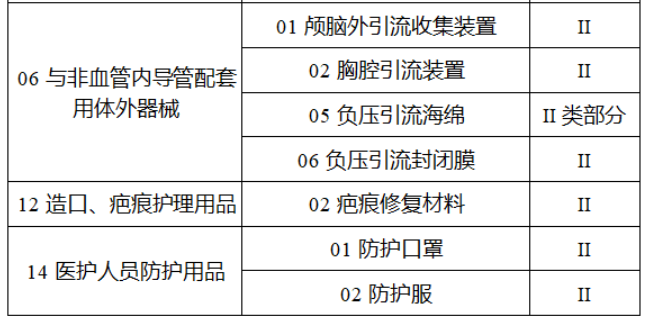
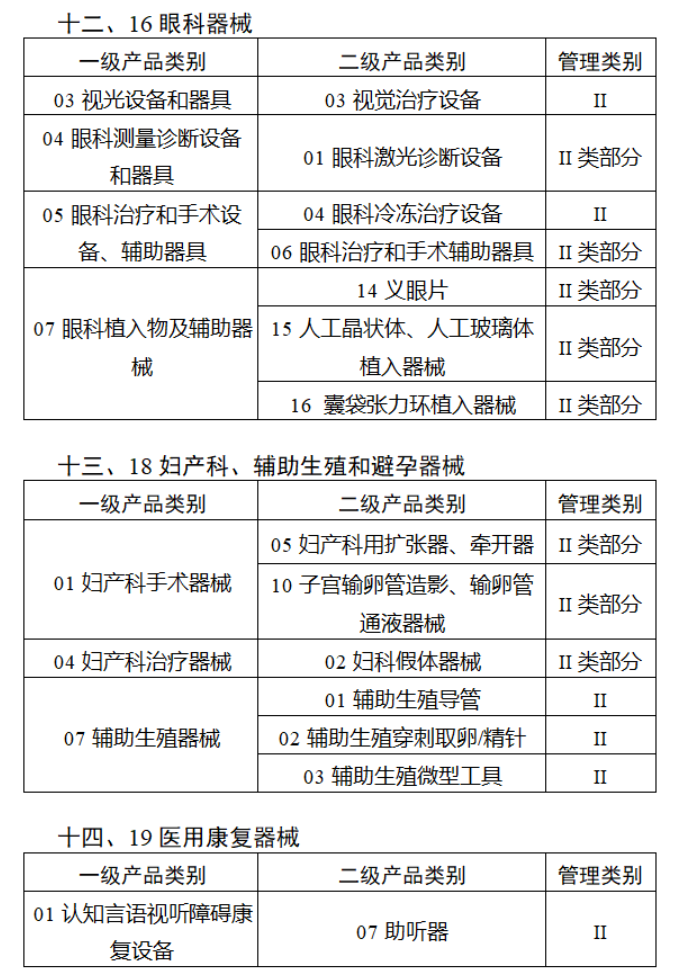
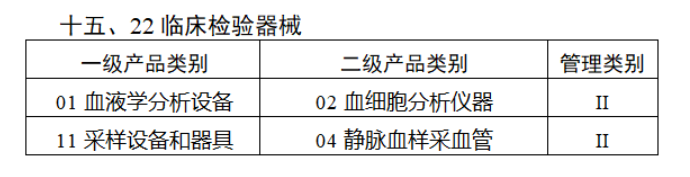
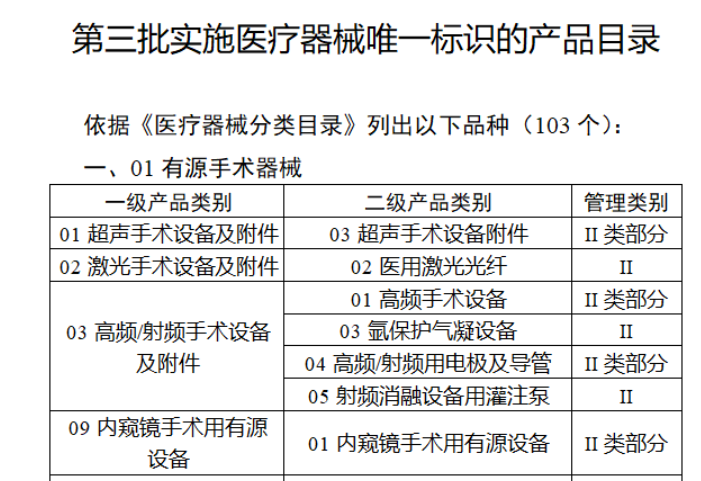
截至目前,第三類醫療器械的(de)唯一标識工作均已開展。全國範圍内,UDI也(yě)将進一步覆蓋部分(fēn)二類醫療器械。《公告》指出,按照(zhào)風險程度和(hé)監管需要,确定部分(fēn)臨床需求量較大(dà)的(de)一次性使用(yòng)産品、集中帶量采購(gòu)中選産品、醫療美(měi)容相關産品等部分(fēn)第二類醫療器械作爲第三批醫療器械唯一标識實施品種。共有103種醫療器械被納入此次唯一标識實施工作中,包括超聲手術設備、激光(guāng)手術設備及附件、高(gāo)頻(pín)/射頻(pín)手術設備及附件、内窺鏡手術用(yòng)有源設備、神經和(hé)心血管手術器械-心血管介入器械、骨科手術器械、診斷X射線機、光(guāng)治療設備、起搏系統分(fēn)析設備、注射泵、臨床檢驗器械等。
根據《公告》,對(duì)列入第三批實施産品目錄的(de)醫療器械,注冊人(rén)應當按照(zhào)時(shí)限要求有序開展以下(xià)工作:2024年6月(yuè)1日起生産的(de)醫療器械應當具有醫療器械唯一标識;此前已生産的(de)第三批實施唯一标識的(de)産品可(kě)不具有唯一标識。生産日期以醫療器械标簽爲準。2024年6月(yuè)1日起申請注冊的(de),注冊申請人(rén)應當在注冊管理(lǐ)系統中提交其産品最小銷售單元的(de)産品标識;2024年6月(yuè)1日前已受理(lǐ)或者獲準注冊的(de),注冊人(rén)應當在産品延續注冊或者變更注冊時(shí),在注冊管理(lǐ)系統中提交其産品最小銷售單元的(de)産品标識。産品标識不屬于注冊審查事項,産品标識的(de)單獨變化(huà)不屬于注冊變更範疇。2024年6月(yuè)1日起生産的(de)醫療器械,在其上市銷售前,注冊人(rén)應當按照(zhào)相關标準或者規範要求将最小銷售單元、更高(gāo)級别包裝的(de)産品标識和(hé)相關數據上傳至醫療器械唯一标識數據庫,确保數據真實、準确、完整、可(kě)追溯。對(duì)于已在國家醫保局醫保醫用(yòng)耗材分(fēn)類與代碼數據庫中維護信息的(de)醫療器械,要在唯一标識數據庫中補充完善醫保醫用(yòng)耗材分(fēn)類與代碼字段,同時(shí)在醫保醫用(yòng)耗材分(fēn)類與代碼數據庫維護中完善醫療器械唯一标識相關信息,并确認與醫療器械唯一标識數據庫數據的(de)一緻性。
當醫療器械最小銷售單元産品标識相關數據發生變化(huà)時(shí),注冊人(rén)應當在産品上市銷售前,在醫療器械唯一标識數據庫中進行變更,實現數據更新。醫療器械最小銷售單元産品标識變化(huà)時(shí),應當按照(zhào)新增産品标識在醫療器械唯一标識數據庫上傳數據。
02
在醫療器械領域,以往流通(tōng)使用(yòng)環節無碼或者一物(wù)多(duō)碼現象普遍,給監管帶來(lái)阻力。醫療器械唯一标識(Unique Device Identification,簡稱UDI)相當于是醫療器械的(de)身份證,由産品标識和(hé)生産标識組成,産品标識是識别注冊人(rén)/備案人(rén)、醫療器械型号規格和(hé)包裝的(de)唯一代碼;生産标識包括與生産過程相關的(de)信息,包括産品批号、序列号、生産日期和(hé)失效日期等,可(kě)與産品标識聯合使用(yòng)。全球範圍内,UDI都是醫療器械監管領域關注的(de)焦點和(hé)熱(rè)點。據了(le)解,2013年,國際醫療器械監管機構論壇發布醫療器械唯一标識系統指南(nán)。同年,美(měi)國發布醫療器械唯一标識系統法規,要求利用(yòng)7年時(shí)間全面實施醫療器械唯一标識。2017年,歐盟立法要求實施醫療器械唯一标識,日本、澳大(dà)利亞、阿根廷等國家也(yě)相繼開展相關工作。國家醫保局此前指出,從政府管理(lǐ)角度,醫療器械監管部門利用(yòng)UDI,可(kě)構建醫療器械監管大(dà)數據,實現醫療器械監管來(lái)源可(kě)查、去向可(kě)追、責任可(kě)究;衛生行政管理(lǐ)部門利用(yòng)UDI,可(kě)提升對(duì)醫療用(yòng)械使用(yòng)行爲的(de)規範管理(lǐ)水(shuǐ)平,推動建立健康醫療大(dà)數據;醫保部門利用(yòng)UDI,有助于在招标采購(gòu)中精準識别醫療器械,實現結算(suàn)透明(míng)化(huà),打擊欺詐行爲。而從産業發展角度,醫療器械注冊人(rén)備案人(rén)實施UDI,有助于提升企業信息化(huà)管理(lǐ)水(shuǐ)平,建立産品追溯體系,提升企業管理(lǐ)效能;醫療器械經營企業實施UDI,可(kě)建立符合現代化(huà)的(de)物(wù)流體系,實現醫療器械供應鏈的(de)透明(míng)化(huà)、可(kě)視化(huà)、智能化(huà);醫療機構實施UDI,可(kě)實現院内耗材精準管理(lǐ),減少用(yòng)械差錯。2021年1月(yuè)1日,國内9大(dà)類69種第三類醫療器械第一批實施醫療器械唯一标識。2022年6月(yuè)1日,其他(tā)第三類醫療器械(含體外診斷試劑)第二批實施醫療器械唯一标識。據賽柏藍器械觀察,此前已有海南(nán)、福建、四川、北(běi)京、天津等省市提前推進第二類醫療器械唯一标識工作,部分(fēn)企業積極開展二類醫療器械UDI工作。
03
多(duō)碼聯動,招采、支付透明(míng)化(huà)伴随國家層面UDI新規的(de)出台,接下(xià)來(lái)全國所有地區(qū)将全面推進前述醫療器械的(de)唯一标識工作。對(duì)于醫療器械注冊人(rén)而言,《公告》談到,要鼓勵基于唯一标識建立健全追溯體系,做(zuò)好産品召回、追蹤追溯等有關工作。對(duì)于因《醫療器械分(fēn)類目錄》動态調整導緻産品管理(lǐ)類别發生變化(huà)的(de)情況,醫療器械注冊人(rén)應當按照(zhào)調整後管理(lǐ)類别的(de)要求實施唯一标識。《公告》還(hái)指出,醫療器械經營企業要在經營活動中積極應用(yòng)唯一标識,做(zuò)好帶碼入庫、出庫,實現産品在流通(tōng)環節可(kě)追溯。醫療機構要在臨床使用(yòng)、支付收費、結算(suàn)報銷等臨床實踐中積極應用(yòng)唯一标識,做(zuò)好全程帶碼記錄,實現産品在臨床環節可(kě)追溯。值得(de)關注的(de)是,醫療器械身份證也(yě)将與國家醫保編碼關聯使用(yòng)。根據《公告》,省級藥品監督管理(lǐ)部門要加強唯一标識工作的(de)培訓指導,結合實施工作推進需求做(zuò)好産品注冊系統改造,組織轄區(qū)内醫療器械注冊人(rén)按要求開展産品賦碼、數據上傳和(hé)維護工作,加強與轄區(qū)内衛生、醫保部門協同,推動三醫聯動。省級衛生健康部門要指導轄區(qū)内醫療機構積極應用(yòng)唯一标識,加強醫療器械在臨床應用(yòng)中的(de)規範管理(lǐ)。省級醫保部門要加強醫保醫用(yòng)耗材分(fēn)類與代碼與醫療器械唯一标識的(de)關聯使用(yòng),推動目錄準入、支付管理(lǐ)、帶量招标等的(de)透明(míng)化(huà)、智能化(huà)。目前,國家醫保編碼的(de)推進工作已進入最後一公裏。兩碼聯動後,醫療器械全鏈條也(yě)将迎來(lái)全新監管。
文章(zhāng)來(lái)源:賽柏藍器械
- END -